Vacinação Já!
Anvisa aprova uso emergencial de vacinas contra a covid-19
Órgão estabeleceu regras para que empresas solicitem a autorização. Decisão favorável foi unânime entre os diretores e ainda não recebeu nenhum pedido de uso emergencial da vacina contra covid-19, nem pedido de registro
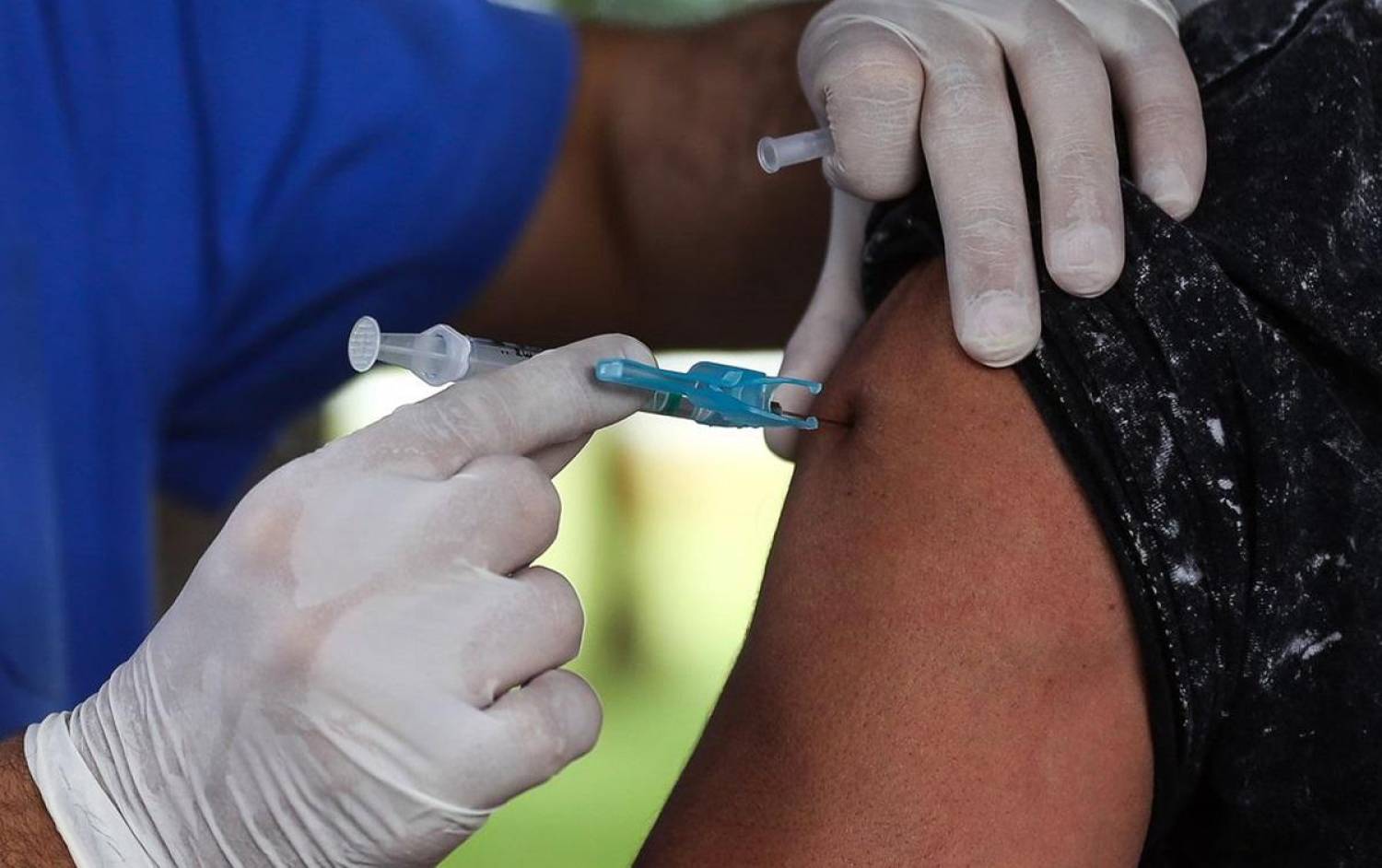
A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou, ontem quinta-feira (10), a autorização temporária de uso emergencial, em caráter experimental, de vacinas contra a covid-19. O órgão estabeleceu regras para que empresas solicitem a autorização e a decisão favorável foi unânime entre os diretores.
A medida, agora, permite que empresas possam fazer esse pedido de emergência. A diretora da Anvisa Alessandra Bastos Soares explica que a autorização de uso emergencial é um mecanismo que pode facilitar a disponibilização e o uso das vacinas contra a covid-19. “Ainda que não tenham sido avaliadas sob o crivo do registro, desde que cumpram com os requisitos mínimos de segurança, qualidade e eficácia”, disse na reunião.
Entretanto, a Anvisa ainda não recebeu nenhum pedido de uso emergencial da vacina contra covid-19, nem pedido de registro. Alessandra ainda reforçou que esse pedido deve ser feito pela empresa. “Qualquer autorização concedida pela Anvisa, qualquer anuência, só será feita diante de um pleito. A vacina só terá autorização de uso emergencial e experimental se houver o pleito realizado por alguma empresa.”
Vacinas emergenciais
O Reino Unido começou, na última terça-feira (8), além do Bahrein e Canadá, a fornecer as primeiras doses da vacina contra a covid-19 da Pfizer, com a BioNTech, após a aprovação emergencial do imunizante no país. Na primeira leva, cerca de 50 hospitais oferecem a vacina para pessoas acima de 80 anos, profissionais do sistema de saúde sob maior risco e funcionários de casas de repouso.
Até o momento, estão em análise as vacinas da Astrazeneca/Fiocruz, Janssen, Pfizer e a Sinovac/Butantan. Todas passaram por duas fases dos procedimentos, exceto a da Fiocruz que chegou até a terceira etapa, com resultados parciais enviados e está com documentações em vistoria.
As vacinas Astrazeneca/Fiocruz e Sinovac/Butantan também já passaram pela fase de "certificação de boas práticas e fabricação" e tiveram as inspeções realizadas.
A agência ressalta que o “uso emergencial” é diferente do “registro sanitário”, que é a aprovação completa para uso de um imunizante. O registro definitivo depende de mais dados e da conclusão de todas as etapas de teste da vacina.
Entenda cada uma das fases:
Fase 1 - essa é a primeira etapa de testes em humanos para avaliar a segurança e possíveis reações indesejáveis no local da aplicação da vacina ou no organismo. Nessa fase também pode ser verificada, de forma preliminar, a imunogenicidade da vacina, ou seja, sua capacidade de gerar anticorpos contra o novo coronavírus.
Fase 2 - é hora de avaliar a dose, a forma de vacinação e a capacidade de gerar anticorpos (contra o novo coronavírus) na população (faixa etária, por exemplo) que deverá ser indicada para receber a vacina. A segurança continua em análise aqui.
Fase 3 - os testes nessa etapa são realizados em grandes populações para avaliar a segurança e a eficácia da vacina. A vacina precisa provar que, de fato, é capaz de nos proteger da doença.
Pedido de uso emergencial - feito antes do registro final para aplicar a vacina em um grupo específico da população. Precisa ser enviado à Anvisa pela empresa fabricante ou importadora da vacina, presente no território brasileiro. Pode ser realizado com a fase 3 em andamento. Saiba mais sobre esse tipo de pedido.
Registro - profissionais especializados da Agência vão revisar todos os documentos técnicos e regulatórios e verificar os dados de segurança e eficácia, bem como avaliar a qualidade da vacina. O registro concedido pela Anvisa é o sinal verde para que a vacina seja comercializada e disponibilizada no país. Precisa ser solicitado à Anvisa pela empresa fabricante da vacina.
Fonte Rede Brasil Atual e Correio Braziliense
Postado por Gustavo Mesquita em Notícias



![Voltar ao topo [Voltar ao topo]](https://b.santosbancarios.com.br/themes/seeb/images/seta-topo.png)